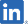| 開発コード | 対象疾患 | 地域 | 非臨床 | 臨床試験 | 申請 | 承認/上市 | 進捗状況 | 提携先 (対象地域) |
||
|---|---|---|---|---|---|---|---|---|---|---|
| 第Ⅰ相 | 第Ⅱ相 | 第Ⅲ相 | ||||||||
|
SP-05 MORE INFO |
大腸がん | 日本 |
|
|
|
|
|
|
臨床開発プログラム検討開始 |
ー |
SP-05
当社は2020年8月にSP-05の日本における独占的開発販売権をIsofol Medical ABより獲得しました。
SP-05 (arfolitixorin)は、フルオロウラシルの抗腫瘍効果の増強を適応とする開発品です。Isofol社は、これまで当該開発品の抗腫瘍効果の増強作用を検討するための研究開発を欧州にて行ってまいりました。Isofol社の実施した第Ⅱ相臨床試験等の結果、進行大腸がん(結腸直腸がん)患者さんにおいて、フルオロウラシルの抗腫瘍効果を増強する効果が示唆されております。
開発状況:臨床開発プログラム検討開始(日本)
2018年12月に権利導入元Isofol社が北米(米国、カナダ)、欧州、オーストラリア、日本において国際共同第Ⅲ相臨床試験を開始。
2022年11月 第Ⅲ相臨床試験終了、主要評価項目未達、開発停止
2024年3月 開発再開決定、臨床開発プログラム検討開始
2024年4月 Isofol社 欧州において臨床試験を開発
予定対象疾患領域
フルオロウラシルの抗腫瘍効果の増強
SP-05は、大腸がん(結腸直腸がん)に対する治療薬の新規候補化合物であり、フルオロウラシルが用いられる膵臓がん、乳がん、胃がん、頭頸部がん等の治療においてもその効果が期待されます。
DNA合成阻害剤であるフルオロウラシルと葉酸製剤(ホリナート・レボホリナート)の併用は、大腸がんに対する化学療法の基本であり、葉酸製剤はフルオロウラシルの抗腫瘍効果を高める作用を有しています。現在、日本において承認されている葉酸製剤はいずれも、生体内でMTHF ([6R]-5, 10-methylenetetrahydrofolate)という活性代謝物に変換されます。
SP-05の有効成分(API)は、MTHF ([6R]-5, 10-methylenetetrahydrofolate)そのものであり、フルオロウラシルとの併用により、既存治療法に比してより強力な抗腫瘍効果を発揮することが期待されます。