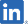| 製品名(開発コード) | 適応/効果 | 地域 | 非臨床 | 臨床試験 | 申請 | 承認/上市 | 進捗状況 | 提携先 (対象地域) |
||
|---|---|---|---|---|---|---|---|---|---|---|
| 第Ⅰ相 | 第Ⅱ相 | 第Ⅲ相 | ||||||||
|
ダルビアス® 点滴静注用135mg(SP-02) MORE INFO |
末梢性T細胞リンパ腫 (PTCL) | 日本 |
|
|
|
|
|
|
2022年販売開始 追加適応の検討開始 |
日本化薬 (日本)
(南米) |
| 韓国、台湾、香港 |
|
|
|
|
|
|
第Ⅱ相最終試験完了 導出活動継続 | |||
| 南米 |
|
|
|
|
|
|
日本での承認を基に、域内各国での承認申請準備中(コロンビア・ペルーは申請済) | |||
| 中国 |
|
|
|
|
|
|
米国データ及び日本の承認を基に開発戦略策定中 導出活動継続 | |||
| 米国 |
|
|
|
|
|
|
前期第Ⅱ相臨床試験完了 導出活動継続 | |||
| 欧州 |
|
|
|
|
|
|
日本での承認を基に、戦略供給体制を構築 | |||
SP-02
当社はSP-02(一般名:ダリナパルシン)の全世界権利をAlaunos Therapeutics (Nasdaq: TCRT)より獲得しました。
SP-02は、抗腫瘍活性を有する有機ヒ素化合物であり、種々の血液がん及び固形がんの治療のために開発が進められてきた新規のミトコンドリア標的薬剤です。本剤の作用機序は、ミトコンドリア機能の障害、活性酸素種の産生増加、及び細胞内シグナル伝達系への作用と推定されており、細胞周期の停止及びアポトーシスを誘導することで抗腫瘍効果を示すと考えられています。
2020年6月、再発又は難治性の末梢性T細胞リンパ腫(Peripheral T-Cell Lymphoma:PTCL)の患者さんを対象とした、日本、韓国、台湾及び香港にて実施されたアジア国際共同第II相臨床試験において主要評価項目(抗腫瘍効果)を達成し、2021年6月に日本において製造販売承認申請を行い、2022年6月に承認されました。
開発状況: 日本(承認)、 韓国・台湾・香港(承認申請準備中)
予定対象疾患領域
末梢性T細胞リンパ腫(Peripheral T cell Lymphoma: PTCL)
PTCLは、悪性リンパ腫の一種であり、悪性リンパ腫はホジキンリンパ腫と非ホジキンリンパ腫に大別され、非ホジキンリンパ腫はB細胞リンパ腫とT細胞リンパ腫に分類されます。T細胞リンパ腫はさらに細分類されますが、PTCLはその中の一種であり、T細胞リンパ腫の中では患者数が比較的多いとされています。 PTCLに対する標準的治療は確立されておらず、NCCN (National Comprehensive Cancer Network) ガイドラインでは、初発時治療として、臨床試験への参加の他CHOP療法など多剤併用化学療法が推奨されています。 また、再発・難治例に対しても臨床試験への参加の他、多剤併用化学療法や近年承認された薬剤が推奨されていますが、初発時治療と同様に標準治療法は確立されておりません。
PTCLは予後が不良となる場合や治療が難しい場合があり、アンメット・メディカル・ニーズが高い疾患の一つであり、新しい治療法・治療薬の導入が期待されています。