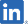| 製品名(開発コード) | 適応/効果 | 地域 | 非臨床 | 臨床試験 | 申請 | 承認/上市 | 進捗状況 | 提携先 (対象地域) |
||
|---|---|---|---|---|---|---|---|---|---|---|
| 第Ⅰ相 | 第Ⅱ相 | 第Ⅲ相 | ||||||||
|
Sancuso®(SP-01) MORE INFO |
悪心・嘔吐(CINV) | 中国 |
|
|
|
|
|
|
2019年販売開始、製造施設変更申請中 |
Lee’s Pharm (中国)
|
SP-01
SP-01は、制吐作用を有するグラニセトロンを持続的に放出するよう設計された経皮吸収型製剤であり、5日間にわたって安定的に血中グラニセトロン濃度を維持することが可能な薬剤です。各種臨床ガイドラインにおいて、抗悪性腫瘍薬投与に伴う悪心・嘔吐に対して5-HT3受容体拮抗薬の使用が推奨されており、5-HT3 受容体拮抗薬のひとつであるグラニセトロンは、抗悪性腫瘍薬の投与に伴う悪心・嘔吐への有効性が既に立証されています。
グラニセトロンを経皮投与することにより、悪心・嘔吐や口内炎が原因で薬剤の服用が困難な状態にある、抗悪性腫瘍薬を投与中の患者さんに特に有用と考えられています。 そして、この特徴ある製剤技術により、治療におけるコンプライアンスの向上と医療現場における業務の簡便化も期待されており、当該経皮吸収型製剤自体も、各種臨床ガイドラインにおいて使用が推奨されています。なお、現時点で、欧米や中国等の諸国において、経皮吸収型5-HT3 受容体拮抗薬は、SP-01のみが当局の承認を得ている医薬品です。
当社は2008年5月に、SP-01の中国、その他東南アジア数カ国における開発販売権をStrakan International Ltd.(現:Kyowa Kirin)より獲得しました。以降、各地域での開発活動等を行い、中国では2018年7月に当局承認を取得し、2019年3月に販売を開始しました。米国では、「高度又は中等度催吐性抗悪性腫瘍剤の最長5日間投与に伴う悪心・嘔吐の予防」を適応として2008年9月にFDAから承認されています(海外販売名:Sancuso®)。また、米国、英国、ドイツ、オランダ、デンマーク、韓国、台湾等の多くの国と地域で販売されています。
開発状況(中国):販売開始済
中国では「中国人健康成人を対象とした臨床薬理試験」ならびに「中国人がん患者を対象とした高度又は中等度催吐性抗悪性腫瘍剤の連日投与に伴う悪心・嘔吐に対する有効性と安全性を検討する二重盲検群間比較試験」を完了し、2014年6月に新薬承認申請(New Drug Application: NDA)を中国当局へ提出し、2018年7月に承認を取得、そして、2019年3月に販売を開始しました。
中国販売においては、提携先であるLee’s Pharmaceutical (HK) Limitedが販売活動を行います。
対象疾患領域
抗悪性腫瘍剤投与に伴う悪心・嘔吐
悪心・嘔吐は、抗悪性腫瘍剤の投与を受ける患者さんにとって最も苦痛を感じる副作用のひとつとされています。悪心・嘔吐が十分にコントロールされない場合、脱水・電解質異常・栄養障害・誤嚥性肺炎等の生命を脅かしかねない多くの合併症を来す可能性があり、このような合併症が起こった場合、入院期間が延長し、看護に要する時間、薬剤資源を含む全般的な医療コストの増大が想定されます。また、抗悪性腫瘍剤の投与に伴う悪心・嘔吐は、患者さんのみならず、ご家族や介護者の生活の質(QOL)の様々な側面に多大な影響を及ぼすと考えられています。
シスプラチン(高用量)のような催吐作用の強い一部の抗悪性腫瘍剤では、90%以上の患者さんに悪心・嘔吐がみられ、また、悪心・嘔吐による苦痛は時間とともに増大し、有効な抗腫瘍療法の効果をも妨げかねません。すなわち、悪心・嘔吐をコントロールすることができない場合、抗悪性腫瘍剤に対するコンプライアンスが低下するおそれがあります。
抗悪性腫瘍剤投与に伴う悪心・嘔吐は、通常,急性(24時間まで)と遅発性(24時間以降)に分類され、急性の悪心・嘔吐の発現は、遅発性の悪心・嘔吐発現の予測因子であると考えられています。また、以前の抗悪性腫瘍剤投与時に悪心・嘔吐が十分にコントロールされなかった場合に、悪心・嘔吐発現の可能性が増大するとされています。 以上の通り、抗悪性腫瘍剤投与に伴う悪心・嘔吐のコントロールは、がん支持療法として重要な目的を有しています。